
药品监管数字化转型探索与实践
摘 要 / Abstract:本文探讨政府数字化转型的要求、方法与路径,梳理药品监管数字化转型的进展与成效,并明确未来方向。重点分析了政府数字化转型的5 个关键要素,阐述了政府信息化4 个阶段的演进路径及数字化转型的典型过程,并进一步聚焦药品监管领域,详细介绍了其数字化转型的内涵、战略规划和实践成果,包括体系建设、大数据建设、网络安全保障、产业发展促进等方面的成效。最后,基于 2025 年这一关键节点,从深化体制机制改革与推进智慧监管能力两大维度,提出下一步努力方向,以期为推动药品监管现代化、服务中国式现代化建设提供参考。
This paper explores the requirements, methods,and pathways of government digital transformation, reviews the progress and achievements of digital transformation in pharmaceutical regulation, and clarifies future directions. It analyzes five key elements of government digital transformation and elaborates on the four-stage evolution of government informatization as well as the typical processes of digital transformation. Focusing on pharmaceutical regulation, the paper details the connotation, strategic planning and practical outcomes of digital transformation-including achievements in system-development, big data construction, cybersecurity protection, and industrial development promotion.Finally, standing at the critical juncture of 2025, it proposes future directions from two dimensions:deepening institutional and mechanism reform and advancing smart regulatory capabilities,with the aim of contributing to the modernization of pharmaceutical regulation and supporting Chinesestyle modernization.
关 键 词 / Key words:政府数字化转型;药品监管;智慧监管;数字政府;监管效能
digital transformation; pharmaceutical regulation; smart regulation; digital government; regulatory efficiency
党的二十大报告明确指出,在新时代新征程中,我们党的中心任务是以中国式现代化全面推进中华民族伟大复兴[1]。数字政府建设作为国家治理体系和治理能力现代化的核心载体,已成为中国式现代化的重要组成部分,对于助力中华民族伟大复兴、推动党在新时代新征程中完成使命任务具有不可替代的关键作用。在这样的背景下,推进以数字化转型为核心的药品监管数字政府建设的重要性日益凸显,将数字技术广泛应用于药品全生命周期监督管理,推进监管流程优化、模式创新和履职能力提升,使药品监管工作与新技术、新业态、新模式不断涌现的高速发展的生物医药产业同频共振,成为实现药品监管现代化的关键路径。本文深入探讨政府数字化转型的要求、方法、路径,梳理药品监管数字化转型取得的工作进展与成效,同时明确未来努力的方向,以期为药品监管数字化转型提供有力的支持和参考,助力药品监管领域更好地服务于中国式现代化建设的宏伟目标。
01 政府数字化转型要求
在当今数字时代,政府数字化转型已成为提升治理效能、优化公共服务、推动经济社会高质量发展的关键路径。近年来,国家陆续出台了一系列重要文件, 为政府数字化转型指明了方向、提供了遵循。2021 年12月,国家发展和改革委员会印发《“十四五”推进国家政务信息化规划》,作为“十四五” 期间政府数字化转型的实践指南,明确了坚持“ 大平台、大数据、大系统”的发展思路,强调要充分运用新技术、新理念和新模式,提升政府治理能力、优化公共服务,形成与数字经济发展相适应的数字治理能力[2]。2022 年 6 月,《国务院关于加强数字政府建设的指导意见》发布,作为政府数字化转型的顶层指导性文件,进一步强调了数字政府建设对于引领数字经济和数字社会发展、营造良好数字生态、加快数字化发展的重要意义,指出其是建设网络强国、数字中国的基础性和先导性工程,也是推进国家治理体系和治理能力现代化的重要举措。该文件还提出了数字政府建设的五大体系框架,包括数字化履职能力体系、安全保障体系、制度规则体系、数据资源体系以及平台支撑体系,为数字政府建设提供了系统的架构设计[3]。2023年2 月,中共中央、国务院印发《数字中国建设整体布局规划》,对数字政府建设提出了新的要求,如构建高效协同的数字政务体系,加快制度规则创新,强化数字化能力建设,提升数字化服务水平等[4]。这些要求旨在促进信息系统网络互联互通、数据按需共享和业务高效协同,同时推进线上线下融合,规范政务移动互联应用管理。
从上述文件可以看出,推动政府数字化转型需要着重关注以下关键要素。①理念转型。要积极践行风险治理、责任治理、智慧治理等现代化监管理念[5],为数字化转型工作提供全新的视角和方向,引导政府从传统管理模式向科学、高效模式转变,以适应快速变化的社会需求。②组织职能转型。应以优化政府职责体系为引领,推动组织架构、运行机制、人才培养和组织文化的全面变革。打破部门界限与功能分割,以业务为核心,形成跨部门协作的灵活工作机制,整合资源,提高行政效率,为公众提供优质便捷的服务。③业务转型。作为提升政府履职效能的核心,需在新的监管理念指导下,按照使命驱动、数据驱动的原则,对监管业务进行重构,创新业务模式,优化业务流程。同时,积极探索非现场、穿透式等新型监管手段[6],推动政府履职效能持续优化,实现监管与服务能力的全面提升。④制度转型。政府应加快制度规则创新,完善与数字政府建设相适应的规章制度,确保体制机制改革与数字技术应用深度融合。通过制度转型,优化业务模式、业务流程和业务逻辑,为数字化转型提供坚实的制度保障。⑤技术转型。作为数字化转型的基石,需要构建健全的技术体系架构,涵盖技术架构、数据架构和安全架构。在技术架构方面,要完善云平台和一体化应用支撑平台;在数据架构上,要加强数据治理和数据中台建设,沉淀数据服务能力;在安全架构中,要引入态势感知、数据安全、数据分类分级和零信任体系等先进技术体系。同时,特别强调数据底座建设的重要性,坚持数据赋能,充分发挥数据作为基础资源和创新引擎的作用[7],提升政府决策的科学化水平和管理服务效率,构建主题明确、协同发展的技术合作生态圈,共同推动政府数字化转型进程。
02 政府数字化转型演进路径
政府信息化工作经历了4 个阶段:①电子化阶段。以单机辅助办公为特征,使局部业务从手工、纸质方式转向电子化。②网络化阶段。以互联网连接为特征,通过业务流程重组,实现线下办公到线上办文办事的转变。③数据化阶段。在前两个阶段的基础上,积累了大量监管数据,数据价值日益凸显,信息化工作进入以数据融合应用为特征的阶段,数据治理同业务创新有机结合,充分发挥数据效能,引领监管创新。④智能化阶段。数据的价值从资源到资产再到要素不断提升,目前正处于以新一代人工智能、机器学习、深度学习等智能技术的快速发展和广泛应用为特征的阶段,致力于推进智慧治理、智能感知决策和精准服务。其中,数据化阶段和智能化阶段是信息化工作推进的关键时期,通常也被认为是智慧监管的核心阶段。
围绕政府数字化转型,主要经历以下典型过程:①业务数据化。这是政务大数据建设的基石。多年的信息化建设使政府部门建立了多个系统,积累了大量政务数据,为大数据应用提供了坚实的数据基础。②数据资产化。分散、未治理的数据价值有限,难以成为资产。数据资产化是通过系统化的数据治理,将杂乱、碎片化的数据转化为具备完整性、唯一性、一致性、准确性、合法性、及时性、系统性的数据资产,以灵活、高质量地提供数据服务,创造业务价值。数据资产正日益成为推动数字中国建设和加快数字经济发展的重要战略资源[8],也是政府数字化转型的基石。③资产价值化。在数据资产化基础上,利用以人工智能和机器学习为核心的大数据建模技术,实现基于数据模型的场景驱动创新[9],展现数据资产的价值。④价值服务化。梳理具有应用价值的共性服务能力,封装成可复用的标准化服务中台,如业务中台、数据中台、技术中台、组织中台等,通过中台为业务赋能。⑤服务业务化。虽然大数据源于传统业务,但它催生了面向全域场景的新业务。服务业务化是指通过技术与管理手段,如云原生、微服务、服务网格、应用编程接口等,对中台等服务进行高可靠的运营管理,确保服务质量。政府数字化转型是一个循序渐进的过程,需要在各个阶段和环节中不断探索和创新,以实现高效治理和服务型政府的目标。
03 药品监管数字化转型工作进展与成效
3.1 转型内涵:重构现代药品监管体系
药品监管数字化转型是信息技术与药品监管业务深度融合的创新实践。它以云计算、大数据、人工智能等新一代信息技术为支撑,充分汲取药品监管科学的最新研究成果,通过对业务、技术、管理、制度等全方位的转型与创新,实现监管体系的重构与监管效能的全面提升。其目标是打造感知敏锐、判断精准、开放协同、敏捷智能的现代化药品监管体系,推动药品监管工作向科学化、法治化、国际化、现代化迈进,全方位保障公众用药安全,促进医药产业高质量发展,为健康中国建设筑牢药品安全防线。
3.2 战略规划:转型的行动指南与蓝图
国家药品监督管理局(以下简称国家药监局)组建以来,高度重视信息化工作,明确提出发展药品智慧监管战略,并确立了以信息化引领药品监管现代化的总方针。2019 年,《国家药品监督管理局关于加快推进药品智慧监管的行动计划》发布,正式开启了药品监管数字化转型的新征程。该文件从顶层设计层面规划了药品智慧监管的总体框架与重点任务,明确了药品监管信息化建设的方向与路径,为后续工作的开展提供了清晰指引[10]。《国务院办公厅关于全面加强药品监管能力建设的实施意见》[11]、《“十四五”国家药品安全及促进高质量发展规划》[12] 相继出台,进一步为“十四五”期间药品监管体系和监管能力现代化建设绘制了宏伟蓝图,明确了药品监管工作的重点任务与发展目标,为药品监管数字化转型提供了坚实的政策保障与战略支撑。
2022 年5 月,《药品监管网络安全与信息化建设“十四五”规划》(以下简称《规划》)发布,标志着药品监管数字化转型迈入了新的发展阶段[13]。《规划》系统总结了药品监管信息化建设的现状与需求,明确了“十四五”期间药品监管网络安全与信息化建设的指导思想、基本原则与总体目标,并提出了重点任务与四大保障措施。《规划》内容丰富、体系完整,可概括为“一个中心、四个基本点、四项原则、三大目标、五大能力、十六项任务”。其中,“一个中心”即以人民为中心的发展思想,充分体现了药品监管工作的根本宗旨与价值追求;“四个基本点”涵盖了落实“四个最严”要求,遵循“四化”(科学化、法治化、国际化、现代化)道路,践行四大治理理念(风险治理、责任治理、信用治理、全程治理),以及推进“四链”(生产链、产业链、责任链、监管链)融合等关键内容,为药品监管工作提供了全方位的行动指引与实践遵循;“四项原则”强调坚持系统思维与统筹协同、业务引领与数据驱动、技术赋能与融合创新、集约建设与安全可控,确保药品监管信息化建设的科学性、规范性与可持续性;“三大目标”聚焦于打造更完善的平台支撑、更智能的大数据驱动以及更全面的大系统应用,为药品监管工作提供强大的技术动力与保障;“五大能力”则涵盖了升级“两品一械”智慧监管能力、提升政务一体化服务能力、推进监管数据融合与驱动能力、筑牢药品智慧监管数字底座支撑能力以及夯实网络安全综合保障能力等多个维度,旨在全面提升药品监管的现代化水平与综合效能。通过规划的实施,药品监管数字化转型的方向更加明确,路径更加清晰,药品智慧监管总体框架不断完善(图1),为后续工作的深入推进奠定了坚实基础。
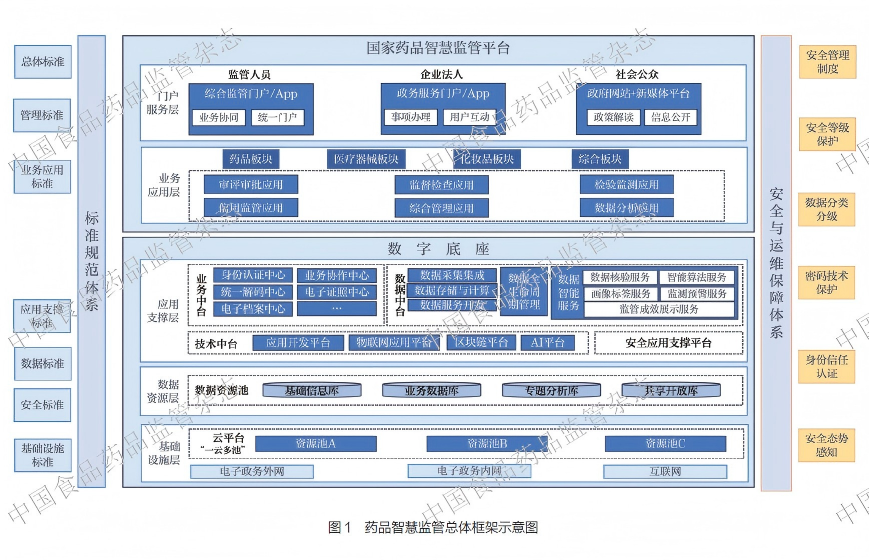
3.3 实践成果:转型的丰硕收获
在《规划》的引领下,国家药监局持续践行以信息化引领药品监管现代化的战略,全力推动药品智慧监管工作,取得了显著的阶段性成效。
在体系建设方面,药品智慧监管体系不断迭代升级,逐步完善。国家药品智慧监管平台成功建成并投入使用,实现了与50 余个业务应用系统的高效对接,为国家、省、市、县四级共2 万用户提供更加便捷、高效的监管服务。该平台的建设显著提升了药品监管的协同性与高效性,实现了药品监管领域的一网通办、一网统管以及一网协同,极大地优化了药品监管的工作流程与协同机制,进一步强化了精准监管和科学监管[14]。国家药监局在国家药品智慧监管平台和全国一体化药品监管数据资源体系打造的“全国互联 一网协同 基于药品监管领域跨省协同探索与实践”凭借其创新性与实用性,成功入选中国信息协会“2024 年数字政府卓越贡献类创新实践案例”,为数字政府建设贡献了药监力量。
在大数据建设方面, 国家药监局全力推进“两品一械”品种档案与信用档案的建设工作,成功实现了“一品一档”与“一企一档”的监管新模式。目前,全品种全过程的监管大数据体系已基本形成,为药品监管工作提供了海量、全面、精准的数据支持,监管“数字底座”更加夯实[15]。通过深度挖掘与分析这些数据,药品监管工作得以实现更加科学、精准、高效的决策与管理,有效提升了药品监管的数字化水平与现代化能力,为药品质量安全保驾护航。
在网络安全保障方面,国家药监局持续加强药监云平台建设,不断完善“云网端数”一体化防护体系,全方位提升网络安全防护能力。多年来,国家药监局始终坚守网络安全底线,确保不发生重大网络安全事件,为药品监管信息化建设营造了安全稳定的网络环境。
在促进产业发展方面,国家药监局通过深化“放管服”改革,持续优化政务服务水平,全力推动医药产业高质量发展。目前,国家药监局 政务服务事项已全部实现在线办理,局本级涉企证照电子化率达到100%[16],切实减少了办事环节、申请材料、办理时间以及群众跑腿次数,大幅提升了审评审批效率与服务质量。这不仅极大优化了营商环境,激发了医药产业的创新活力与发展动力,还使得近年来由国家药监局审批上市的创新药械数量呈现稳步增长态势,生物医药新质生产力得以蓬勃发展,为医药产业的转型升级与高质量发展注入了强大动力。
在推进产业数字化转型方面, 国家药监局信息中心联合国家药监局食品药品审核查验中心先后印发《疫苗生产检验电子化记录技术指南(试行)》《血液制品生产检验电子化记录技术指南(试行)》等一系列指导性文件,为医药产业的数字化转型提供了明确的技术标准与操作规范。同时,国家药监局与工业和信息化部等部门协同合作, 联合印发《医药工业数智化转型实施方案(2025—2030 年)》,共同推进医药工业智能制造与药品智慧监管的协同发展,构建“双智”联动发展格局,助力医药产业迈向数字化、智能化新时代,提升我国医药产业在全球产业链中的地位与竞争力[17]。
在保障药品安全方面,国家药监局积极探索创新全生命周期数字化监管方式方法, 全方位守护公众用药安全。在生产环节, 针对特殊药品、血液制品、疫苗、中药注射剂等高风险品种,大力开展生产过程非现场监管模式的探索与实践。在此基础上, 于2024 年6 月, 印发《血液制品生产智慧监管三年行动计划(2024—2026 年)》[18],全面加快推进血液制品生产智慧监管工作,推动药品生产数字化监管步入快车道,实现监管效能的全面提升。在流通与使用环节,持续完善药品、疫苗信息化追溯体系建设。特别是在新冠疫情期间,通过对所有新冠疫苗的全程追溯管理,实现了疫苗来源可查、去向可追,确保了抗疫药品生产与流向信息的实时掌控。同时,基于追溯大数据构建风险预警模型,对麻醉药品、精神药品等高风险药品的流通异常情况进行精准监测预警,为执法办案提供有力支持。此外,为强化网络空间药品安全风险治理,国家药监局不断健全网络监测体系,构建起基于多模态的网络销售监测平台与舆情监测系统,对全国2.7 万家网络销售平台及各类社交媒体进行统一监测与分级处置,确保网络空间药品安全风险可管可控,有效维护了公众用药安全与网络药品市场秩序。
04 下一步努力方向
4.1 深化改革:转型的必然要求
2025 年作为“十四五”规划的收官之年,具有承前启后、继往开来的重要意义,既是“十四五”规划各项任务目标的总结验收之时,也是药品监管改革全面深化、再出发的关键节点。在这一重要历史关头,全面落实中央改革部署成为药品监管工作的重中之重。必须以高度的政治责任感与使命感,不折不扣地贯彻执行中央的各项改革要求,确保改革任务落地生根、取得实效。同时,紧密围绕《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》这一重要文件精神,深入推进药品智慧监管提质行动。聚焦药品监管改革创新促发展的中心任务,以扎实的调查研究为先导,深入基层一线,广泛听取各方意见与建议,精准把握药品监管工作中的痛点难点问题。在此基础上,坚持问题导向,运用系统思维,强化业务协同联动,打破部门之间、业务之间的壁垒,形成工作合力,更大程度地释放信息化对药品监管现代化的引领势能,推动药品监管工作在改革中不断创新、在创新中砥砺前行,为医药产业高质量发展创造更加优越的政策环境与监管条件。
4.2 智慧监管:转型的核心抓手
站在新的历史起点上,必须坚定不移地坚持全国“一盘棋”的战略思维,精心谋划顶层设计,从全局高度统筹谋划药品监管信息化建设的各项工作任务,确保全国药品监管数字化转型的方向一致、步伐协同。遵循“一体化”原则,全力推进智慧监管体系建设,实现药品监管业务的全方位整合与流程优化,打造一个高度协同、高效运行的智慧监管整体架构。持续完善药品监管“一张网”,不断拓展监管网络的覆盖范围与深度,织密监管覆盖网络,确保药品监管无死角、无盲区,为公众用药安全提供全方位、立体式的保障。
在数字化转型方面,要纵深推进,持续加大工作力度。全力实施《“数据要素×”三年行动计划(2024—2026 年)》,深度挖掘数据潜力,充分发挥数据在药品监管工作中的乘数效应,通过数据驱动实现监管业务的创新与突破,释放数据价值,为药品监管决策提供更加精准、科学的依据。加速《国务院关于深入实施“人工智能+”行动的意见》的落地实施,积极引入人工智能技术,提升监管效能,实现监管工作的自动化、智能化与精准化,有效降低监管成本、提高监管效率。同时,充分运用“穿透式监管”“非现场监管”等新型监管手段,让监管工作既全面覆盖又高效精准,及时发现与防范药品安全隐患,全方位保障公众用药安全有效,为医药产业的高质量发展营造更加稳定、透明、可预期的监管环境,助力健康中国建设行稳致远。
作者简介:陈锋,博士,国家药品监督管理局信息中心,研究员。专业方向:药品智慧监管
【参考文献】略 来源:中国食品药品监管杂志



 京公网安备 11010202010537号
京公网安备 11010202010537号 